多总管3月8日讯
摘要abstract
又有多款CAR-T疗法药物获CDE承办受理
四家企业提交富马酸替诺福韦二吡呋酯片仿制申请
默沙东帕博利珠单抗注射液(PD-1单抗)申请上市
CFDA公布第二批通过仿制药一致性评价公告
注射用紫杉醇(白蛋白结合型)首仿药获批生产
承办情况
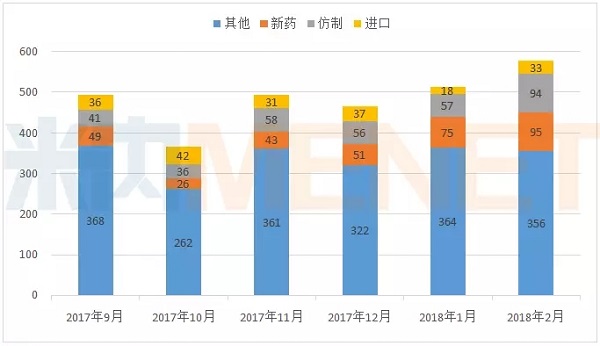
据MED中国药品审评数据库2.0统计,2018年2月CDE共承办药品注册申请578个,2月CDE承办药品注册申请并未受春节假期影响,承办申请同比1月有所上升。
图1:2017年9月-2018年2月CDE承办药品注册申请情况(按受理号计)
(数据来源:MED中国药品审评数据库2.0,下同)
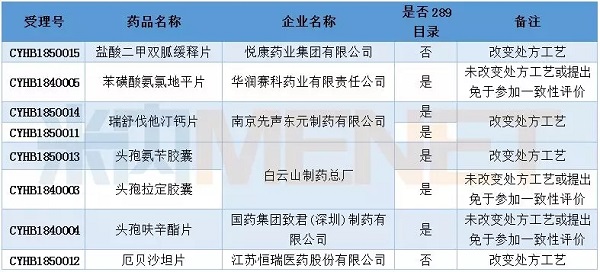
2月有8个一致性评价申请获CDE承办,涉及7个品种,其中盐酸二甲双胍缓释片以及厄贝沙坦片属于非289目录品种。
表1:2018年2月仿制药一致性评价受理情况
国内新药承办
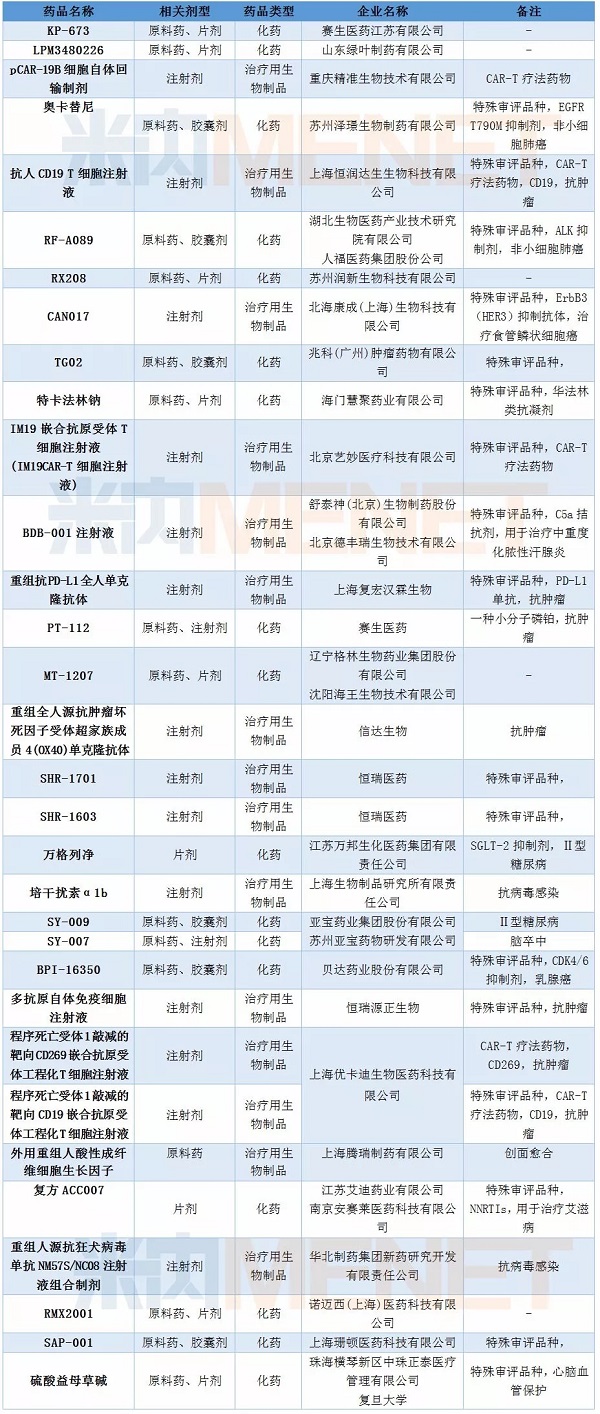
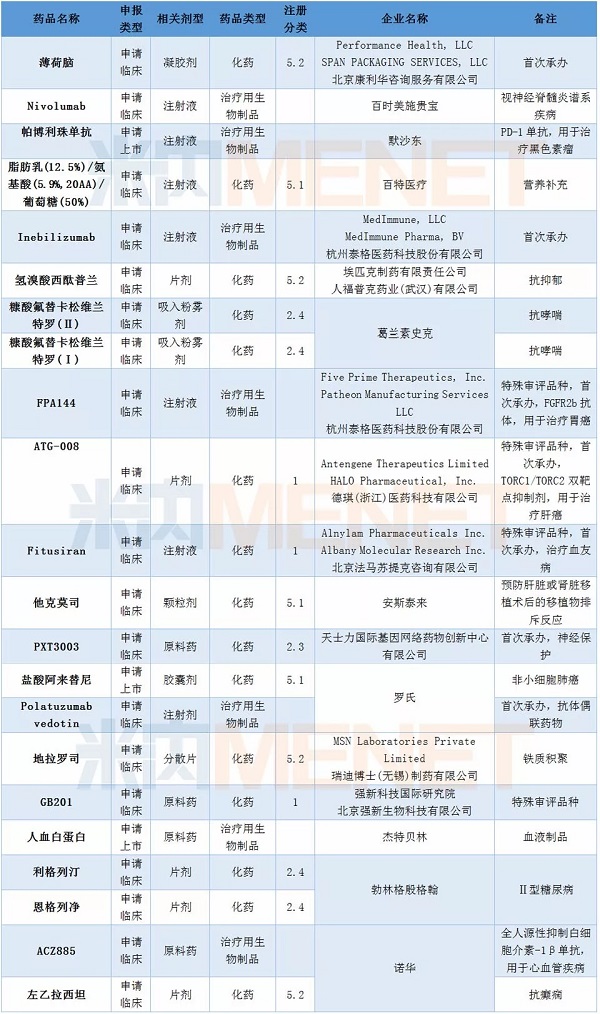
2月新药申请有95个,其中属于1类新药的申请有63个,涉及32个药品通用名,均为临床申请。重庆精准生物、上海恒润达生生物、北京艺妙医疗科技均有一款CAR-T疗法药物进入CDE,而上海优卡迪生物在2月再有两款CAR-T疗法药物获得承办,目前该企业已有3款CAR-T疗法药物进入CDE。自2017年12月首个CAR-T疗法药物获CDE承办后,目前CDE在审的CAR-T疗法药物已超过10个。
表2:2018年2月1类新药承办情况
国内仿制承办
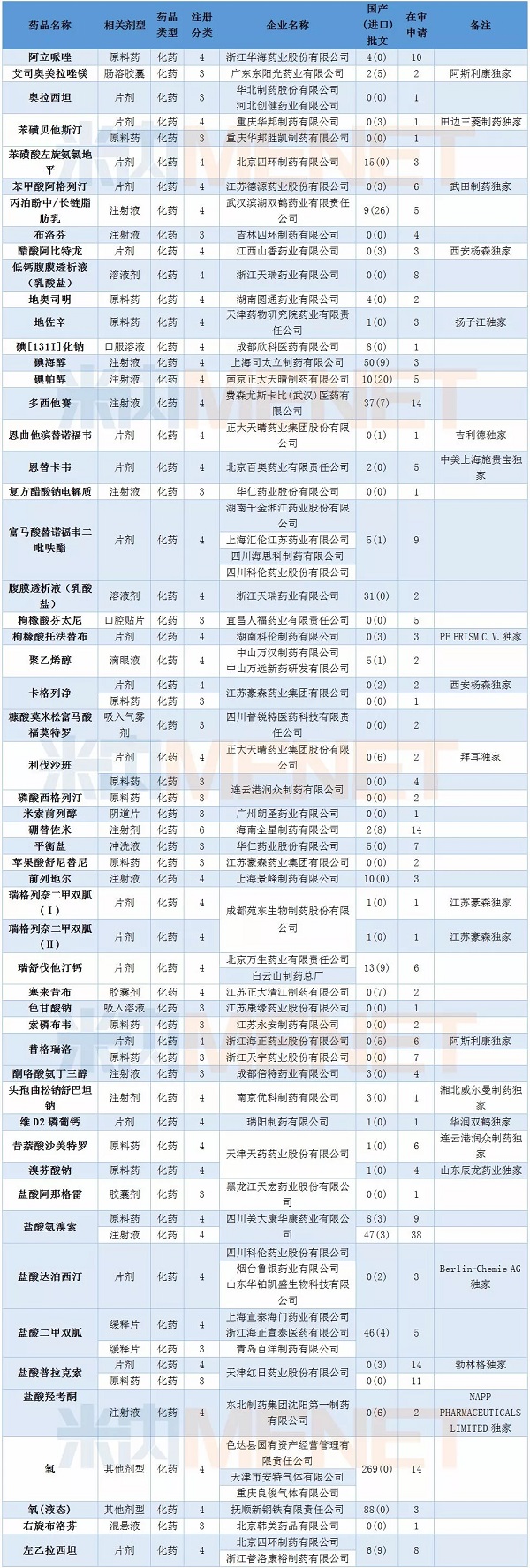
2月CDE共承办仿制药申请94个,涉及53个品种,其中有20个品种目前为国内独家品种。碘海醇注射液、盐酸氨溴索注射液以及盐酸二甲双胍缓释片目前国内已有批文较多,有同质化迹象。
值得一提的是2月有四家企业的富马酸替诺福韦二吡呋酯片仿制申请获CDE承办。截至2018年2月底已有2个厂家通过该品种的仿制药一致性评价,目前该品种的在审仿制申请有9个,竞争十分激烈。
表3:2018年2月仿制申请承办情况
(在审申请仅统计申请类型为新药、仿制和进口受理号)
进口申请承办
2月份CDE承办了33个进口申请,涉及21个品种,其中有7个品种为CDE首次承办品种。默沙东的帕博利珠单抗注射液、罗氏的盐酸阿来替尼胶囊以及杰特贝林人血白蛋白原料药上市申请。
表4:2018年2月CDE进口申请承办情况
审批情况
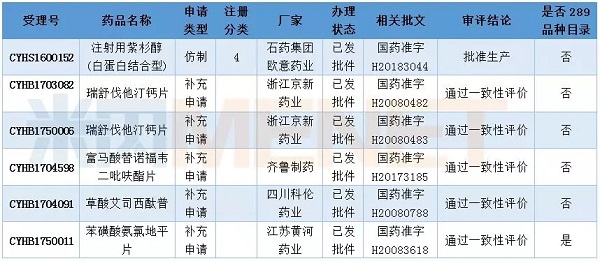
2月有6个品种通过仿制药一致性评价。石药集团欧意药业的注射用紫杉醇(白蛋白结合型)首仿获批生产,该申请为新4类仿制申请,视为通过一致性评价,同时该品种也是第二个通过一致性评价的注射剂(四川汇宇制药的注射用培美曲塞二钠为首个通过一致性评价的注射剂)。
此外,CFDA在2月公布了第二批通过仿制药质量和疗效一致性评价的公告,本次共有5个品种,复星药业旗下江苏黄河药业成为首家通过苯磺酸氨氯地平片一致性评价的厂家,齐鲁制药则成为正大天晴之后第二家通过富马酸替诺福韦二吡呋酯片一致性评价的厂家。
表5:2018年2月部分申请获批情况
来源于:米内网