多总管
文丨张红利
近日,国家药品监督管理局更新了罗氏HER2-ADC药物注射用恩美曲妥珠单抗(ado-trastuzumabemtansine,商品名为Kadcyla®)的办理状态,变为“在审批”,预计将于近期获批上市。
2019年3月27日,Kadcyla在中国的上市申请获得CDE承办,受理号为JXSS1900012/13,并于2019年6月进入优先审评通道。若顺利获批,恩美曲妥珠单抗将成为国内首个上市的ADC药物。
Kadcyla由曲妥珠单抗(trastuzumab,赫赛汀活性药物成分)与ImmunoGen公司细胞毒制剂DM1通过一种稳定的链接子二联而成,将DM1递送至HER2阳性乳腺癌细胞。Kadcyla于2013年获批上市,是首个也是唯一一个获批作为单一制剂用于治疗既往已接受赫赛汀和紫杉烷化疗(单独或联合治疗)的HER2阳性转移性乳腺癌患者的抗体药物偶联物。
抗体药物偶联物(antibodydrugconjugate,ADC)是一种新型的靶向抗肿瘤药物,它利用单克隆抗体将连接的细胞毒药物靶向输送至肿瘤细胞部位,以增强抗体治疗活性、增加细胞毒药物杀伤肿瘤细胞的靶向性,并降低其对正常组织的毒副作用。
目前,尚无ADC药物在中国获批上市,而国内在研ADC药物中以HER2为靶点的数量最多。HER2是人表皮生长因子受体(EGFR)家族蛋白的一员,HER2阳性乳腺癌约占全部乳腺癌的20%~25%,该类型乳腺癌侵袭性较高,预后差。根据弗若斯特沙利文报告,2014年至2018年间,中国晚期HER2阳性乳腺癌患者的数量由1.57万增加至1.69万,年复合增长率为1.8%。预计到2023年,中国晚期HER2阳性乳腺癌患者人数将达1.82万,随后患者人数将以1.0%的年复合增长率持续增长,并于2030年达到1.96万。
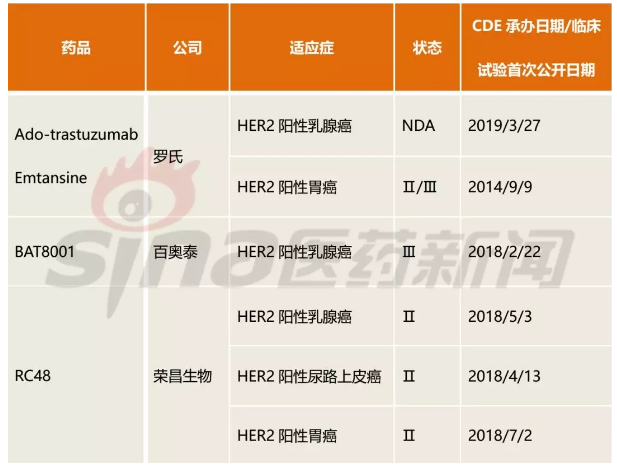
除了罗氏,国内也有多家企业开始布局ADC药物市场,包括百奥泰、荣昌生物、恒瑞医药、浙江医药、石药、复星医药、上海交联等,其中进展较快的是百奥泰的BAT8001(Ⅲ期)和荣昌生物的RC48(Ⅱ期),其他均处于I期临床阶段。
表1中国进入临床Ⅱ期以上的抗HER2单抗ADC药物
原文有删减
来源于:新浪医药新闻