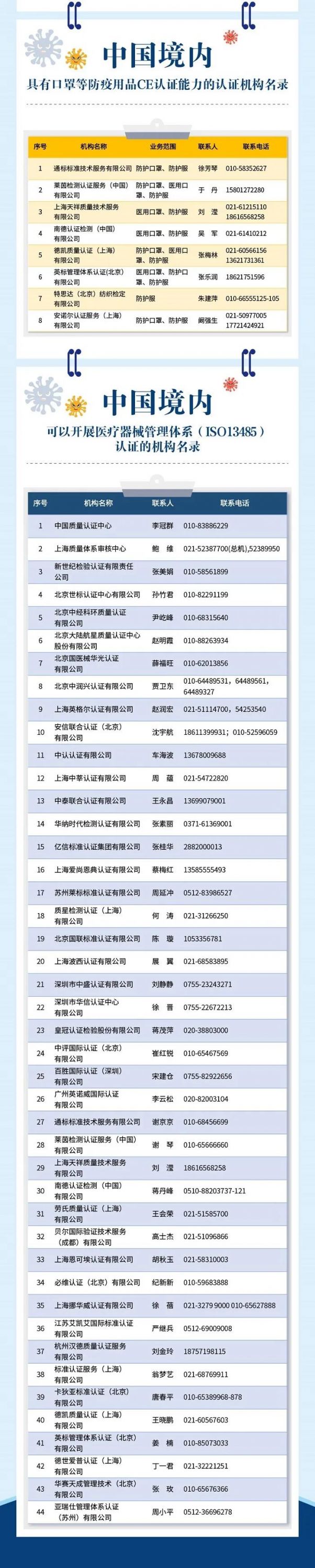
多总管4月7日讯 目前国内企业向欧盟、美国等国出口口罩需要通过欧盟的CE认证、美国FDA注册程序。采访中,记者了解到,目前很多企业并不了解这个信息,不知道哪些机构具备相应资质,很多企业盲目委托中介机构申请国外认证,甚至出现排队办理出口认证的情况,有的企业还遭受损失。
4月5日,国家市场监督管理总局认证监管司司长刘卫军在“国务院联防联控机制新闻发布会”上介绍,经过初步梳理,已经编制出一份口罩等防疫产品出口到欧盟和美国的认证信息指南,在市场监管总局、国家认监委的网站,以及公众号上都可以看到。
刘卫军介绍,这份认证信息指南包括欧盟CE标志、美国FDA注册等相关要求。这份指南还为
企业提供了快速、直接了解这些要求以及解决问题的途径。
另外,有些进入欧盟的产品,需要经过欧盟授权的公告机构的认证,在中国都有哪些机构能够做这项业务?在指南里也列出了这些机构的名录。在医疗器械领域,国际上还有ISO13485医疗器械管理体系的标准,企业需要获得这个体系认证。哪些机构能做这项工作?指南里也有相应的信息。
这份指南今后还会不断更新,为企业提供便利,帮助企业解决实际困难。
“假证”举报拨打12315
采访中,记者了解到,现在网上“花钱”就能办到CE证书的“假宣传”层出不穷。如果企业遇到这种办证的情况,办了假证应该怎么办?
刘卫军表示:“疫情发生以来,市场监管总局特别注重对防疫产品认证的违法违规行为进行查处,现正在查处冒用认证标志、虚假宣传认证信息的案件。”
他表示,特别是针对现在出口的一些不规范认证行为,市场监管总局专门部署要开展专项整治行动,《关于开展口罩、防护服等防疫用品领域认证活动的专项整治行动的通知》已经正式下发,整治重点主要有伪造冒用买卖认证证书、未经批准擅自从事认证活动、认证活动不规范以及认证价格违法的行为。
以去年为例,市场监管总局查处了87家违规认证机构,占认证机构总数的15%,其中5家问题严重,直接撤销了资质。另外,2家国外的认证机构在中国没有经过批准,就非法开展认证活动,已经在网上进行了警示公告。对电商平台销售的认证产品,市场监管局也加强了核查,去年电商就下架了17000多件相关产品。
如果遇到类似问题,市场监管局提示,可以拨打12315投诉举报热线,或者12315网络平台,都可以进行投诉举报。
机构选择至关重要
刘卫军提醒道,第一,一定要找合法的认证机构。中国现在经过批准的有600多家认证机构,从事产品、服务、管理体系等认证,这是指所有的认证活动,不仅仅针对出口。这些信息在国家认监委的网站上都可以查询到,企业如果要做认证,一定要找具有相应合法资质的机构,千万别被不良机构给忽悠了。
第二,一定要了解出口目的国的市场准入要求。指南里也作了一些这方面的说明,比如出口到欧盟的医用口罩分两类,一类是无菌的,一类是非无菌的。对非无菌医用口罩,欧盟规定只要企业按照相关要求作出符合性自我声明,就可以加贴CE标志。而对无菌医用口罩,就必须找欧盟授权的机构才能获得真正的CE认证,产品才能进入到欧盟市场。如果是输往美国,企业可以按照美国的管理规定,通过FDA的网站申请并提交相关材料。
第三,出口企业一定要按照我国和目的国的规定开展生产经营活动,加强
产品质量管理。商务部、海关总署、药监局前几天刚发布公告,明确要求相关医疗物资出口必须获得我国医疗器械产品注册证书,同时要满足进口国(地区)的质量标准要求。
刘卫军还指出:“如果真是出口中出现了质量方面包括认证评价的问题,一定要积极回应,特别是对那些不实信息和炒作,要积极进行回应,消除误解,这样既保护企业自身利益,也维护中国产品的信誉和形象。”
严管五类产品出口
海关统计数据显示,3月下旬以来,出口疫情防控物资增幅比较大,从3月1日到4月4日,全国共验放出口主要疫情防控物资价值102亿元,主要包括口罩约38.6亿只,价值77.2亿元;防护服3752万件,价值9.1亿元;红外测温仪241万件,价值3.3亿元;呼吸机1.6万台,价值3.1亿元;新型冠状病毒检测试剂284万盒,护目镜841万副。
从贸易方式情况看,主要还是一般贸易,占了约83%,价值85.2亿元。
商务部外贸司一级巡视员江帆介绍,为深化国际疫情防控合作,加强医疗物资出口质量的监管,3月31日,商务部会同海关总署、药监局发布了《关于有序开展医疗物资出口的公告》,要求出口的检测试剂、医用口罩、医用防护服、呼吸机、红外体温计等五类产品,必须取得我国医疗器械产品注册证书,符合进口国(地区)的质量标准要求,海关凭药监部门批准的医疗器械产品注册证书验放。
另外,为做好疫情防控用医疗器械的质量监管,国家药监局与其他部门积极配合,通力合作。会上,国家
药品监督管理局器械监管司副司长张琪也指出,一是强化监督检查。加强对生产企业原材料采购、生产过程控制、产品出厂放行等重点环节的监督检查,督促企业严格依照
法规要求和标准组织生产。对发现的问题,责令企业整改到位,坚决防止不合格产品流入市场,从源头上保障
医疗器械质量安全。
二是强化质量检验。截至3月底,共开展针对疫情防控医疗器械的应急注册检验、应急评价检验以及监督抽检等各种形式的检验共计8069批次,总体质量状况符合要求。
三是强化督导检查。国家药监局、市场监管总局选派多名精干执法人员赴北京、天津、浙江、湖北、广东等14个重点省份,对疫情防控医疗器械质量监管工作进行督导检查,督促各项工作抓实抓细抓落地。
四是严厉打击违法违规行为。国家药监局等八部门联合组织开展严厉打击制售假劣医疗器械违法行为,切实保障防控医疗器械质量安全。有关案例查处情况已在国家药监局网站上公布。
五是及时公开注册信息。对获得批准的产品相关注册信息,在国家药监局网站公布,并根据审批情况及时更新,为采购方选择提供参考,也为相关部门开展出口监管工作提供便利。
来源于:医药经济报